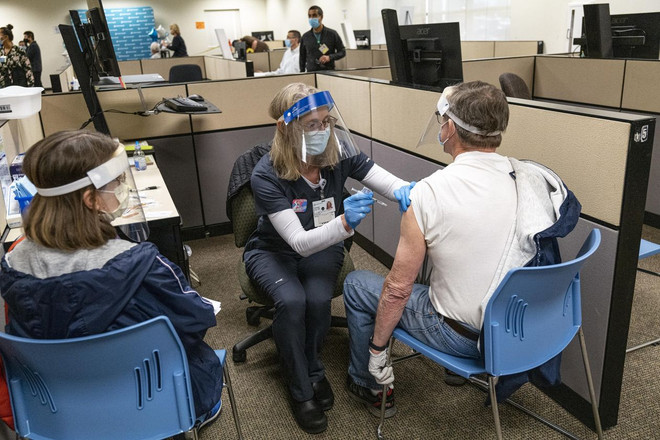
 Nhân viên y tế tiêm vắcxin cho người dân tại Mỹ. (Ảnh: Bloomberg)
Nhân viên y tế tiêm vắcxin cho người dân tại Mỹ. (Ảnh: Bloomberg)
Ngày 4/2, Cơ quan quản lý Thực phẩm và Dược phẩm Mỹ (FDA) thông báo đang chuẩn bị sẵn một quy trình đánh giá nhanh trong trường hợp cần phải bổ sung hoặc điều chỉnh kế hoạch tiêm chủng vắcxin để đảm bảo hiệu quả phòng ngừa các biến thể mới của virus SARS-CoV-2 .
Theo Quyền giám đốc FDA Janet Woodcock, cho biết nếu xảy ra trường hợp cần bổ sung hoặc phải điều chỉnh kế hoạch tiêm chủng thì cơ quan này sẽ xem xét cấp phép cho các loại vắcxin mà không yêu cầu phải tiến hành thử nghiệm trên diện rộng trước.
Quy trình mới có thể sẽ chỉ cần các thông tin về an toàn và nếu có thể sẽ triệu tập một ủy ban gồm các chuyên gia độc lập đánh giá về việc tiêm các mũi vắcxin bổ sung. FDA có kế hoạch đưa đề xuất về quy trình mới ra lấy ý kiến công chúng trong vài tuần.
Pfizer và đối tác BioNTech hay Moderna, những hãng dược phẩm có vắcxin được cấp phép sử dụng khẩn cấp tại Mỹ, đều đã chuẩn bị cho khả năng cần các mũi tiêm bổ sung để đối phó với những biến thể mới của virus SARS-CoV-2.
[Giới chức châu Âu nhóm họp về việc cấp phép vắcxin của Moderna]
Bà Woodcock cho biết các loại vắcxin hiện hành vẫn cho hiệu quả bảo vệ hợp lý trước các biến thể mới của virus. Tuy nhiên, việc quyết định sớm về quy trình cấp phép sẽ giúp FDA chủ động ứng phó nhanh trong trường hợp cần thiết.
Cũng trong ngày 4/2, hãng dược phẩm Johnson&Johnson đã nộp đơn xin cấp phép khẩn cấp với vắcxin phòng COVID-19. Quá trình đánh giá sẽ kéo dài vài tuần và nếu được cấp phép thì vắcxin của J&J là loại thứ 3 được FDA chấp thuận đưa vào sử dụng khẩn cấp.
Theo Janssen Biotech, chi nhánh phát triển vắcxin của Johnson&Johnson, sản phẩm của hãng có 2 lợi thế quan trọng, đó là chỉ cần một liều duy nhất và có thể bảo quản ở nhiệt độ của tủ lạnh thay vì phải cất giữ trong các thùng trữ đông chuyên dụng.
Sau khi Johnson&Johnson nộp đơn, FDA sẽ triệu tập một ủy ban cố vấn đặc biệt, đưa ra các đánh giá dựa trên những dữ liệu về thử nghiệm lâm sàng, để xem liệu lợi ích mà vắcxin mang lại có vượt trội những nguy cơ hay không.
Hồi cuối tuần trước, Johnson&Johnson công bố những kết qua thử nghiệm lâm sàng đầu tiên thực hiện với gần 44.000 người tại 8 quốc gia. Theo đó, nhìn chung vắcxin có hiệu quả phòng ngừa 66% trong khi hiệu quả ngăn chặn bệnh diễn biến nặng là 85%. Các vắcxin của Pfizer/BioNTech và Moderna được cấp phép sau khoảng 3 tuần nộp hồ sơ lên FDA.
Biến thể mới phát hiện tại Anh có khả năng lây lan nhanh hơn nhiều, trong khi các biến thể tại Nam Phi và Brazil lại có khả năng làm giảm hiệu quả của vắcxin phòng bệnh. Hiện vẫn chưa có cơ sở cụ thể để quyết định có cần vắcxin mới cho biến thể mới hay không.
Các quốc gia vẫn đang nỗ lực chuẩn bị những biện pháp cần thiết để phát hiện những biến thể gây quan ngại, trong khi giới khoa học cũng cần thống nhất về cơ sở xác định liệu virus đã biến đổi quá nhiều so với bản gốc và cần một loại vắcxin mới hay không./.