Biểu tượng hãng dược Pfizer tại Cambridge, Massachusetts, Mỹ. (Nguồn: AFP/TTXVN)
Biểu tượng hãng dược Pfizer tại Cambridge, Massachusetts, Mỹ. (Nguồn: AFP/TTXVN)
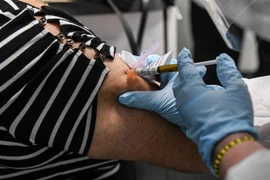
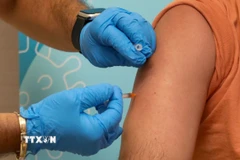
Theo Chính phủ Mỹ và người đồng sáng lập công ty dược phẩm BioNTech, đơn đề nghị cấp phép sử dụng khẩn cấp vắcxin ngừa COVID-19 do hai hãng dược phẩm Pfizer (Mỹ) và BioNTech (Đức) phối hợp phát triển sẽ được nộp lên Cơ quan quản lý thực phẩm và dược phẩm (FDA), Mỹ ngày 20/11.
Bộ trưởng Y tế Mỹ Alex Azar đã xác nhận thông tin trên trong cuộc họp báo ngày 19/11 tại Washington.
Trước đó, BioNTech thông báo hồ sơ xin cấp phép sẽ được hoàn tất trong ngày 19/11 và sẽ được nộp cho FDA.
[Vắcxin của Pfizer và BioNTech có thể được bàn giao trước Giáng sinh]
Việc xin cấp phép vắcxin này chỉ mang tính ngắn hạn nhằm ứng phó với tình hình dịch bệnh khẩn cấp hiện nay, có thể được thu hồi hoặc điều chỉnh tùy thuộc hiệu quả và an toàn thực tế sử dụng sau đó.
Hiện chưa rõ FDA sẽ xem xét hồ sơ trong bao lâu.
Người đứng đầu cơ quan phát triển vắcxin Mỹ Moncef Slaoui từng đề cập khả năng vắcxin ngừa COVID-19 được "bật đèn xanh" cấp phép lưu hành vào tháng 12 tới - cùng thời gian nhà đồng sáng lập BioNTech Ugur Sahin dự kiến trước đó.
Ngày 18/11 vừa qua, Pfizer thông báo kết quả thử nghiệm cuối cùng loại vắcxin ngừa COVID-19 do hãng cùng BioNTech phát triển cho thấy hiệu quả đến 95% và không có tác dụng phụ nghiêm trọng nào./.